עם חומרים שיש בכל בית אפשר להפוך שקית רגילה ל"פצצה" עם מנגנון השהיה
בניסוי זה נכין שקית שמתנפחת ואפילו מתפוצצת 'מעצמה' – בזכות תגובה כימית בין שני תבלינים.
ציוד
- 2 שקיות סנדוויצ'ים קטנות
- אבקת סודה לשתייה (נמצאת באגף מוצרי האפייה במכולת)
- מלח לימון (אפשר למצוא בכל סופר באגף התבלינים)
- מים
- כפית
- מספריים
- צבע מאכל (לא חובה)
מהלך הניסוי
את מהלך הניסוי אפשר לראות בסרטון:
החלק הקשה, מבחינה טכנית, בניסוי - הוא פיצוץ השקית הפנימית עם המים. הנה כמה 'טיפים' שיעזרו לכם להצליח:
- חשוב להקפיד לסגור את שקית המים הפנימית בלי אוויר בכלל - שלא תהייה אפשרות דחיסה של אוויר.
- חשוב לגזור את עודפי השקית שלפני הקשר 'על המילימטר' – כלומר כמה שיותר קרוב לקשר.
- מומלץ לא לסגור את השקית באופן חזק מדי / מהודק - במצב כזה אפילו מעט לחץ על השקית יוכל גם לפתוח את הקשר בלי צורך שהשקית תקרע. רעיון אחר ומומלץ במקום לקשור - לסגור את שקית המים הפנימית בעזרת גומייה, כך לחיצה קלה יחסית תוכל לשחרר אותה.
- חשוב את השקית החיצונית לקשור בלי אוויר בכלל - כדי שתהייה אפשרות ללחוץ עליה בקלות בלי אוויר שמפריע.
- מומלץ, כדי לא לבזבז חומר, לנסות לפוצץ שקית פנימית עם מים, שנמצאת בתוך שקית - בלי שאר החומרים. ורק כשרואים שמצליחים - להמשיך הלאה.
- אם עדיין לא מצליחים - פשוט לשים במקום השקית הפנימית כוסית חד פעמית עם מים, בזהירות. כשרוצים לפוצץ את השקית פשוט הופכים את הכוס הפנימית ומנערים.
גז מפוצץ
כאשר אנו ממלאים שקית באוויר, קושרים, ואז לוחצים עליה חזק עם הידיים – היא מתפוצצת. זה מתרחש בגלל שכאשר אנו לוחצים על השקית אנחנו דוחסים אותה ("מקטינים את נפחהּ" בשפה יותר מדעית) – כתוצאה מכך, הלחץ של הגז (האוויר) שבתוכה עולה ועולה, ולוחץ יותר ויותר על דפנות השקית, עד שהשקית לא עומדת בזה יותר – והיא נקרעת ומתפוצצת.
בניסוי הנוכחי גם יש שקית שמתפוצצת בגלל לחץ של גז. אבל הפעם הלחץ לא נוצר בגלל שלוחצים על השקית עם הידיים, אלא בגלל תגובה כימית, שיוצרת עוד ועוד גז בתוך השקית, מה שגורם לעליה גדולה יותר ויותר בלחץ בתוך השקית – עד הפיצוץ.

שקיות נפוחות לקראת פיצוץ בגלל לחץ של גזים – כשדוחסים שקית (למעלה) וכשנוצר גז בתגובה כימית (למטה) | צילומים מתוך סרטון מדע בבית, צלם: רועי חובני
לחץ של גז שמפוצץ דברים הוא העיקרון הפועל גם בכלי הנשק שיוצרים פיצוץ אמיתי. ההבדל הוא שבכלי הנשק הלחצים הרבה הרבה יותר גדולים מבניסוי שלנו – ולכן גם עוצמת הפיצוץ.
תגובה כימית יוצרת גז
כמו שכתבתי בתחילת הכתבה – בניסוי הנוכחי תגובה כימית בין שני חומרים יוצרת גז שממלא את השקית. שני החומרים הם סודה לשתייה ומלח לימון, והגז שנוצר נקרא פחמן דו חמצני (CO2). באופן כללי סודה לשתייה (או בשמות יותר מדעיים: 'נתרן מימן-פחמתי' / 'סודיום ביקרבונט') שייכת למשפחה של חומרים הנקראים 'בסיסים פחמתיים' או קרבונטים, משום שהם מכילים קבוצה כימית הנקראת קרבונט. מלח לימון או חומצת לימון/חומצה ציטרית (באמת נמצאת בלימון!) – שייך למשפחת החומרים שנקראים חומצות. המיוחד בחומצה הזאת שהיא מוצקה בטמפרטורת החדר – ונראית דומה לגרגירי מלח. החומצות והבסיסים סותרים זה את זה – כלומר מגיבים זה עם זה בתגובה כימית מהירה, שהתוצאה שלה היא סתירה או ביטול התכונות של החומצה והבסיס. ל'בסיסים קרבונטים' יש עוד תכונה מיוחדת: הם יוצרים גז פחמן דו-חמצני בזמן תגובת הסתירה עם חומצות. הרבה ניסויים ביתיים מבוססים על התכונה הזאת כמו הניסוי הר געש של קצף או ניפוח בלון בעזרת הכוח של הכימיה – רק שבהם החומצה היא חומץ, שזאת חומצה נוזלית.
בשקית המתפוצצת שלנו החומצה היא חומצת לימון – שהיא מוצקה, כמו הסודה לשתייה. העניין הוא שמוצקים לא כל כך מגיבים זה עם זה, כי בשביל תגובה כימית החלקיקים הקטנים שבונים את החומר צריכים ממש לזוז ממקום למקום ולפגוש זה את זה. ומה שמאפיין מוצק זה שהחלקיקים שבונים אותו לא זזים ממקומם – הם תפוסים ודבוקים חזק זה לזה.
זה מה שמאפשר לנו ליצור את מנגנון ההפעלה של השקית המתפוצצת – ששומר על כך שהיא תתפוצץ רק מתי שאנחנו נרצה. כל עוד החומרים נשמרים בתור אבקות יבשות הם לא מגיבים זה עם זה. רק כאשר אנו מרטיבים אותם במים – הם מתמוססים במים, ואז החלקיקים שלהם יכולים לזוז ולהגיב זה עם זה – וליצור את הגז שמפוצץ את השקית. באופן כללי, אפשר לרשום בקיצור את התגובה הכימית כך במילים:
סודה לשתייה (מומסת במים) + מלח לימון (מומס במים) מגיבים ליצירת פחמן דו-חמצני (גז) + עוד כמה חומרים כימים.
תגובה כימית יוצרת גז
לבקיאים ולמתעניינים, הנה הרחבה על הכימיה של התגובה המתרחשת בניסוי.
הנוסחה הכימית של סודה לשתייה היא : NaHCO3, הנוסחה הכימית של חומצת לימון היא C6H8O7 והמבנה של המולקולות שמרכיבות אותה הוא כזה:
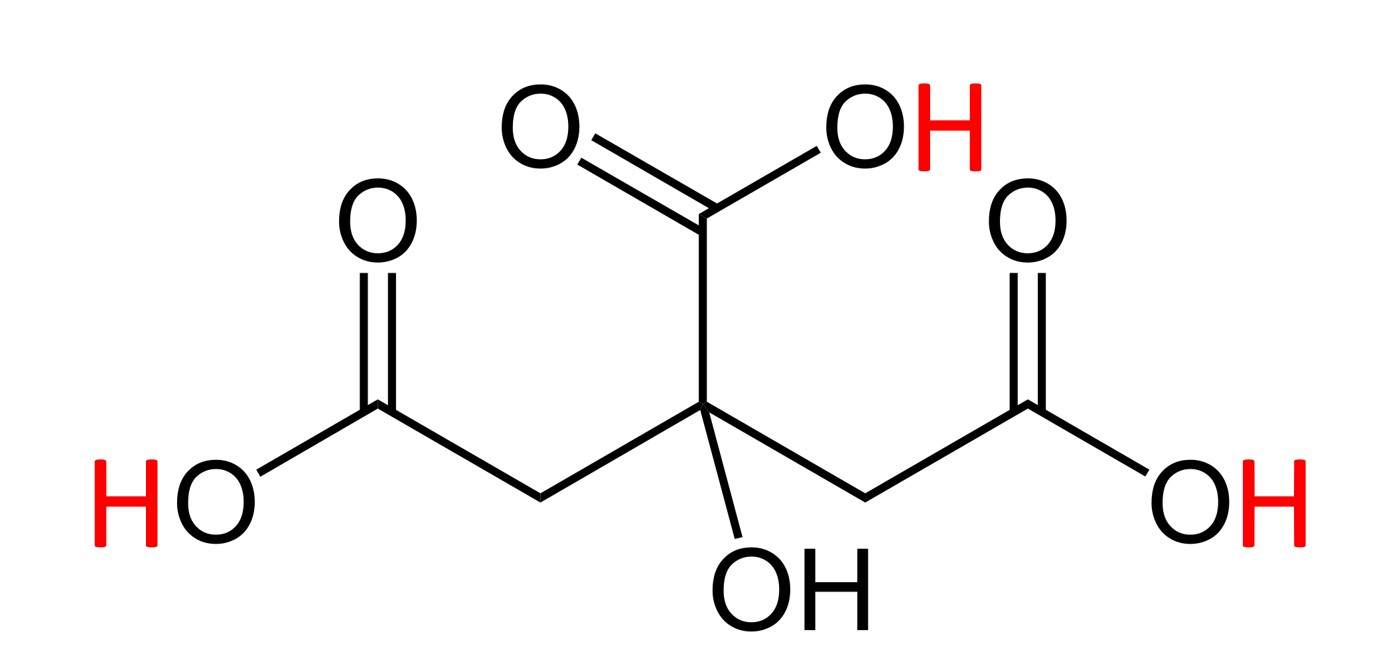
מבנה כימי של חומצת לימון, אטומי הפחמן (C) לא מצויירים. הקווים מציינים קשרים כימיים אל אטומי פחמן. באדום מסומנים שלושת אטומי המימן (H) החומציים
באדום סימנתי את שלושת אטומי המימן ה'חומציים' – שהם למעשה אלו שגורמים לתכונות ה'חומציות' של חומצת הלימון. הם אלו שיכולים להגיב בתגובה כימית עם בסיסים, אם כי לא כל השלושה חייבים להגיב (תלוי בכמות וסוג הבסיס שמוסיפים). ולפיכך התגובה הכימית המלאה המתרחשת בניסוי תהייה:
NaHCO3(aq) + C6H8O7(aq) -------> CO2(g) + H2O(l) + NaC6H7O7(aq)
(aq – קיצור של אקווה – מומס במים, l - מצב נוזל ו-g - מצב צבירה גזי).
כלומר בתגובה הכימית נוצרים, בנוסף לגז הפחמן הדו-חמצני (CO2) גם מים (H2O) וגם מלח נתרן ציטראט מומס במים (NaC6H7O7(aq))
תודה למורה רחל גתי על הרעיון לפיתוח ניסוי זה.
